“医美归医”再进一步,医用透明质酸钠监管新规之下的企业进入新阶段
2022-12-01
“医美归医”再进一步,医用透明质酸钠监管新规之下的企业进入新阶段
在医美产业笔记今年发起的「线上直播大课」中,一位资深连麦嘉宾总结过:“未来医美行业的机会点主要来自三个方面:一是国家经济的高速发展;二是医美行业的发展;三是行业监管的规范化。”
近两年,医美行业的监管政策尤其引人注目,一方面政策的强监管为医美行业的粗放式发展敲响了警钟;另一方面,则为医美行业的可持续发展提供了坚实基础。不管是长期还是短期来看,严监管都利好行业上下游的龙头企业。
11月14日,国家药监局对外发布《关于医用透明质酸钠产品管理类别的公告(2022年第103号)》(以下简称“《公告》”),以加强医用透明质酸钠(玻璃酸钠)产品的监督管理,进一步规范相关产品注册(备案)。
据统计,这是今年第三份比较完善的关于“透明质酸钠”的监管公告。3月30日国家药品监督管理局对外发布《关于调整《医疗器械分类目录》部分内容的公告(2022年第30号)》,初步明确了注射用透明质酸钠、胶原蛋白植入剂等按三类医疗器械监管;5月国家药监局发布公开征求《关于医用透明质酸钠产品管理类别的公告》(修订草案征求意见稿),将此前的内容细分和完善,聚焦在医用透明质酸钠上,规定了11种使用情况下的监管类别;今年11月真正将此前的意见稿作为《公告》发布,可见对透明质酸钠监管的逐渐成熟。
《公告》中明确指出:作为注射填充增加组织容积产品和注射到真皮层,主要通过所含透明质酸钠的保湿、补水等作用,改善皮肤状态应用时,按照第三类医疗器械管理。
透明质酸钠作为中国医美行业应用广泛的一大品类,在市场发展和监管方面都越来越成熟。政策对医美市场的重塑与清洗,正引导行业回归理性,尤其是对于具有先发优势和强大实力的企业来说,严监管更加利好龙头企业。
所以作为能一直符合甚至超过国家监管标准的上游企业,在新规落地之后能释放出更多的发展活力,赢在“起跑线”上。
纵观所有行业,监管尚未落地之前,行业就没有一个准入门槛。此时,行业内产品鱼龙混杂、良莠不齐。当行业监管落地并且一再精细化之后,能砍掉大部分“不合规”的产品,一直走在行业监管之前、高于行业标准的优质产品必定能赢得更大的想象空间。
在医用透明质酸钠领域,除了以上类别的监管,其实还有更细分的行业标准。组织工程医疗器械产品《透明质酸钠 YY/T 1571-2017行业标准》中明确规定了决定透明质酸钠品质的几个关键因素的数值,内毒素<0.05EU/mg、核酸<0.5、蛋白质<0.1。
作为国内少数拥有中国GMP证书,并且原料药登记号为A状态的玻璃酸钠原料药生产企业,众山生物于2021年,依据组织工程医疗器械产品《透明质酸钠 YY/T 1571-2017行业标准》,推出了医用级透明质酸钠系列MEDIHYA®,且该系列产品矩阵不断完善,针对医美市场不同层级原料需求做出了差异化产品线。
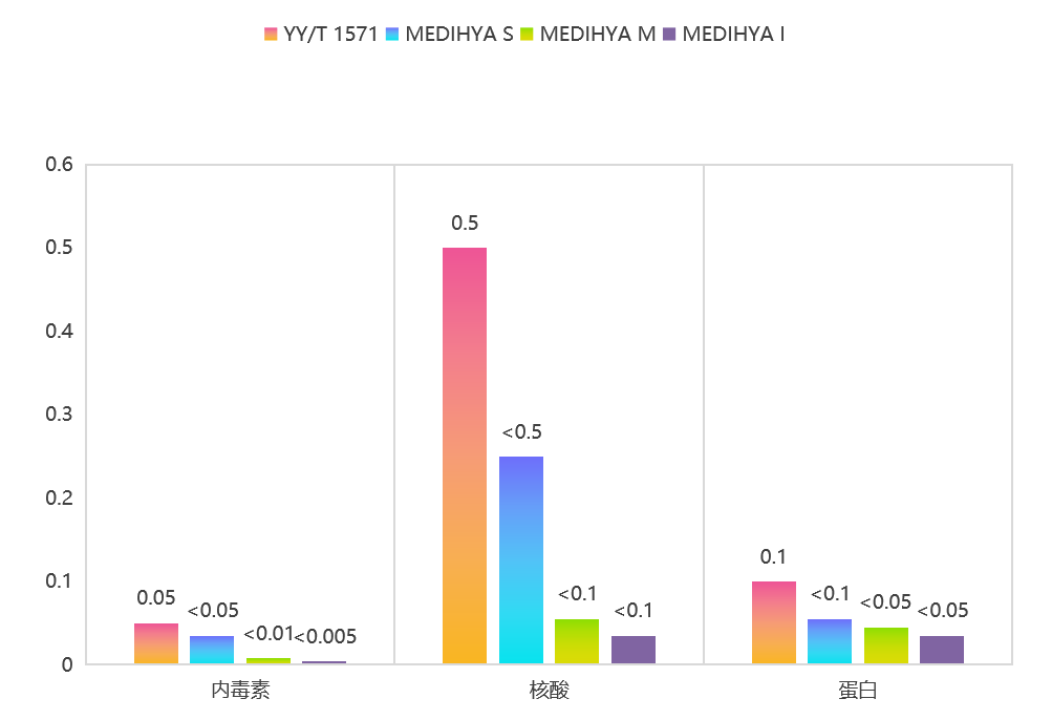
众山生物产品品质一如既往的优于行业标准,该系列的产品同样可应用于Ⅲ类医疗器械,用作医美填充、水光、胸腹部抗粘连及美体手术、人工皮肤移植手术等。与《公告》中规定的“作为注射填充增加组织容积产品和注射到真皮层,主要通过所含透明质酸钠的保湿、补水等作用,改善皮肤状态应用时,按照第三类医疗器械管理”相契合。
而谈到产品品质,则一定要依靠试验得出的科学结论。在2021年7月,权威检测机构对众山生物产品进行了细胞毒性、皮肤致敏性、皮内安全性、急性全身毒性等多项生物学测试,检测结果均显示本品在生物体内是具有高度安全性的。针对《关于医用透明质酸钠产品管理类别的公告(2022年第103号)》中“作为医用敷料应用时,不可被人体吸收且用于非慢性创面,医用敷料按照第二类医疗器械管理”的这一要求,完成了“产品不透皮吸收”和“创面不透皮”的功效实验,进一步拓宽了产品应用范围,同时也为后续产品合规划化审批提供充足的实验数据支持。
其次,从众山生物本身的产品布局来看,目前推出的医用级透明质酸钠系列MEDIHYA®有四款产品,MEDIHYA®I和MEDIHYA®M是医疗注射级透明质酸钠、MEDIHYA®S是医疗器械级透明质酸钠、MEDIHYA®T是医疗外用级透明质酸钠,涵盖医美用品中从外用到注射所有符合标准的产品。其中内毒素水平更是做到了仅为欧洲药典标准值的1/50。
医美行业发展到今天,监管带来的变化一定程度上推动了行业发展,促进市场逐渐成熟。想要真正站在赛道的前沿,产品力固然是第一核心驱动,但是还需要从全局入手,提升企业整体实力。
在透明质酸钠原料领域深耕17年的众山生物,以微生物发酵技术和无菌原料生产技术为核心。产品覆盖生化原料药、组织工程学原材料、功能性护肤成分等领域,其中核心成分透明质酸钠系列,可应用于医药(骨科、眼科)、医学美容(真皮填充剂)、化妆品、健康食品等。据了解,到2018年,化妆品级HA产能便扩大到50吨,满足市场日益增长的需求。
这一方面得益于众山生物基础设施的加速扩建,截至目前,公司总占地已经达到了10万余平方米,建有8个符合GMP标准的生产车间和符合GLP标准化的实验室;另一方面则得益于专业认证地加速推进和研发实力的不断强大,众山生物现有中级以上职称30多人,执业药师30多人,拥有专利30余项,科技成果鉴定达到国际先进3项,新产品4项,国家三类新药11项,欧美等各种国际认证7项,品牌商标35项,参与国家药典标准修订一项。
最重要的是,众山生物是国内少数拥有中国GMP证书的透明质酸钠原料药生产企业之一,并且原料药登记号为A状态。
在透明质酸钠市场不断扩张的今天,为满足更高的需求,众山投入大量的资金、人力、物力,设计并研发出中国第一条无菌HA车间,可以为众多需求高的企业生产无菌透明质酸钠。
也正是众山生物在专业领域的持续深耕,目前已发展成为全球医药级透明质酸领先生产企业、国内无菌玻尿酸原材料领航生产企业。并获得国家级小巨人企业、高新技术企业、省专精特新、市瞪羚企业、省科技型中小企业、创新优胜企业、山东省先进中小企业、山东名牌、市长质量奖提名等多项荣誉称号。
众山生物之所以能成为走在行业前沿的企业,除专业的产品和专业的认证之外,还有一整套完备的服务流程。首先以丰富的产品矩阵为基础,众山生物能满足客户多样化的需求,为客户定制服务和产品。就以MEDIHYA®系列为例,其产品能针对不同功效应用到各类医疗器械产品中;能精准控制10万-300万范围内分子量,完全满足客户定制化需求。
其次,众山生物以强大的研发力为基石,不仅自身积累了原料药的生产和资质基础,还能为客户在产品申报时提供全套生物学评价等资料,更好地进行变更及申报。
众山生物的“服务优势”不仅如此,还包括运输方案的制定及服务。众所周知,透明质酸钠因其特殊性,运输中需冷藏,控制温度以保障产品活性和有效性。众山生物的「温控」运输方案能在10天时间里让温度几乎保持恒定,最大程度地保障了产品的有效性。
2022年是整个医美行业“合规化”再次迈向一个新高度的一年,关于「透明质酸钠」的政策新规不断涌现,整个领域也处于破旧立新的转折期,需要更多头部品牌和专业力量的加持和带领,才能同监管部门一道为行业合规化做出贡献。以众山生物为代表的领军企业不断以专业品质助推行业前行,相信未来也将进一步引领行业,获得长远发展。
如有读者希望对接“众山生物”,可直接拨打电话咨询:0532-80821290